Proporciones
- Obtener vínculo
- X
- Correo electrónico
- Otras apps
Proporciones
Proporciones definidas:
Ley de las Proporciones Definidas se expresa así: “Diferentes átomos se combinan en relaciones simples de números enteros para formar compuestos”. Dicho de otra manera, un compuesto siempre está constituido por los mismos elementos y en la misma proporción en masa. Sin embargo, existen elementos que al combinarse entre sí forman más de un compuesto.
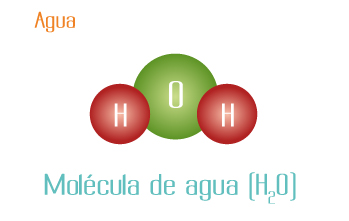
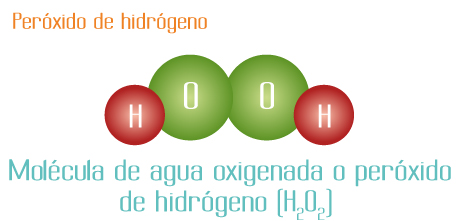
Los elementos hidrógeno y oxígeno forman 2 compuestos diferentes:
La proporción de los átomos de hidrógeno con respecto al oxígeno es 2 H: 1 O en el agua:
La proporción de los átomos de hidrógeno con respecto al oxígeno es 2 H: 2 O en el agua oxigenada.
Si comparamos ambos compuestos observamos lo siguiente:

Como nos podemos dar cuenta, las propiedades físicas del agua (H2O) son completamente diferentes a las del peróxido de hidrógeno o agua oxigenada (H2O2).
Proporciones múltiples:
Esta ley surge en 1803. Explica que las cantidades de un mismo elemento, que se unen con una cantidad fija de otro elemento, forman un compuesto distinto en cada caso, estando en una relación de números enteros sencillos. Dalton observó y estudió un fenómeno del cual Proust no se había percatado, en el que algunos elementos entre sí en distintas proporciones originan compuestos distintos. Hoy se conoce como los diferentes estados de oxidación de un elemento, que permite combinarse en diferentes proporciones con otro elemento.
Dalton descubrió, que una molécula de agua siempre contiene la misma proporción de oxígeno e hidrógeno. Pensó que los átomos de oxígeno eran más pesados que los de hidrógeno y así es, el de oxígeno pesa 16 veces más que el de hidrógeno. Así La ley de proporciones múltiples, se convirtió en prueba clave para la teoría atómica de Dalton, aunque hoy en día, existen dudas de si fue con base en esta ley o lo descubrió por accidente.
Ejemplo de la ley de las proporciones múltiples:
- Óxido nitroso N2O. Se combinan 28 gramos de nitrógeno con 16 gramos de oxígeno siendo N2O 28/1 x 16 = 7/4.
- Óxido de nitrógeno N2O2. Se combinan 28 gramos de nitrógeno con 32 gramos de oxígeno, siendo N2O2 28/2 x 16 = 7/8.
- Y anhídrido nitroso N2O3. Se combinan 28 gramos de nitrógeno con 48 gramos de oxígeno, siendo N2O3 28/3 x 16 = 7/12.
Conviene recordar que, cuando esta ley fue formulada ciertas comprobaciones no podían llevarse a cabo, por ser de carácter empírico. Así tomamos el cobre y el oxígeno, combinamos para formar dos óxidos de cobre distintos, el CuO y el Cu2O. En el primer compuesto, encontramos, 3,973 gramos de cobre y se combinan con un gramo de oxígeno. En el segundo compuesto 7,945 gramos de cobre, se une a cada gramo de oxígeno. Buscamos la relación en 7,945/3,973 y obtenemos un número entero sencillo, el 2 tal como predijo Dalton.
- Obtener vínculo
- X
- Correo electrónico
- Otras apps


Comentarios
Publicar un comentario